Tin Tức
Plasma lạnh Mirari – Giải pháp đột phá cho liền vết thương và kiểm soát nhiễm khuẩn
Trong bối cảnh các vết thương khó lành như loét do tiểu đường, loét tì đè, vết bỏng, vết mổ sau phẫu thuật hay vết thương mãn tính đang ngày càng trở thành nỗi lo lớn của cộng đồng y tế, Plasma lạnh Mirari xuất hiện như một công nghệ tiên tiến, hiện đại, mang lại hy vọng lớn cho cả bệnh nhân lẫn đội ngũ chuyên môn chăm sóc sức khỏe.
Vì sao Plasma lạnh Mirari nổi trội?
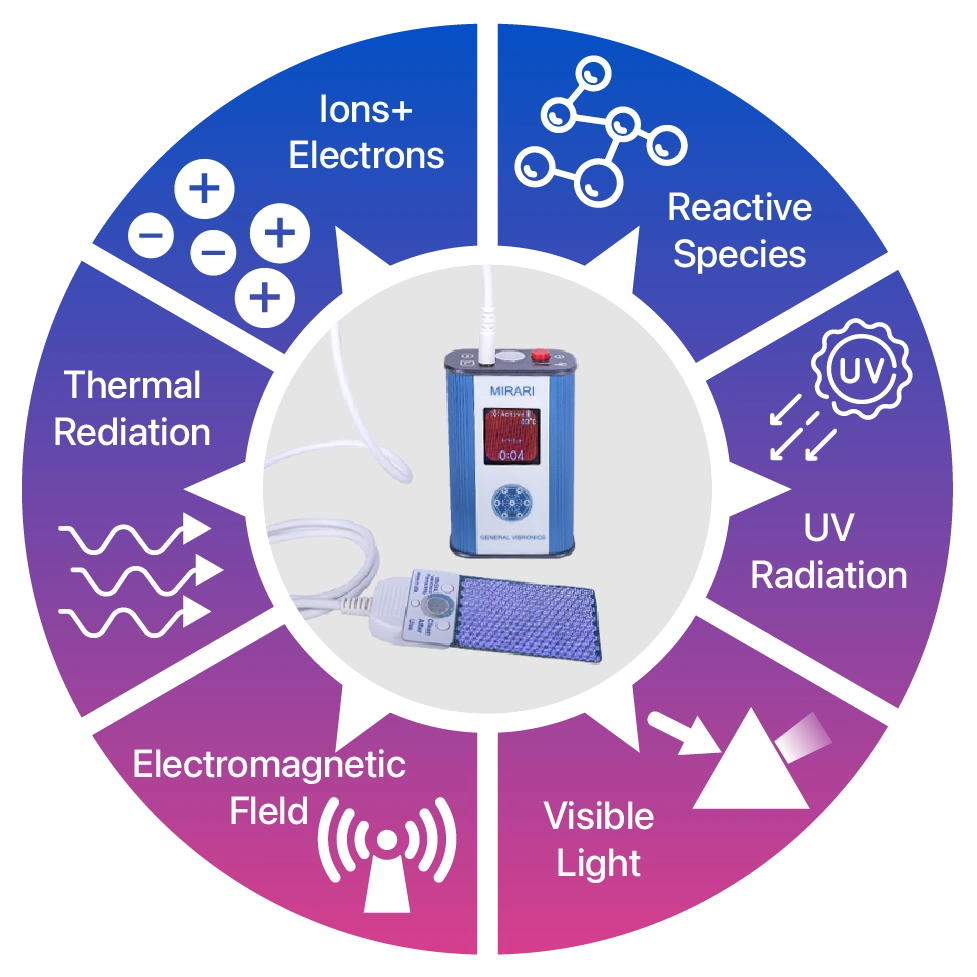
Plasma lạnh Mirari thuộc thế hệ mới ứng dụng công nghệ Plasma khí quyển lạnh (CAP), tạo ra môi trường chứa nhiều electron, ion và các gốc tự do như ROS (gốc oxy phản ứng), RNS (gốc nitơ phản ứng) cùng sóng điện từ và tia UV sống động ở mức năng lượng thấp, hoàn toàn an toàn cho mô sống nhưng lại cực kỳ hiệu quả trong tiêu diệt vi khuẩn, virus và nấm. Nhờ đó, đây là thiết bị y tế không xâm lấn, rủi ro thấp, đã được cấp phép tại thị trường khắt khe như Mỹ (FDA Class II), Thái Lan và Việt Nam (Class B), phù hợp cho các quy trình chăm sóc vết thương trong các bệnh viện, cơ sở y tế và cả tại nhà.

Khả năng diệt khuẩn và kháng viêm xuất sắc
Với sự hiện diện của các thành phần phản ứng mạnh mẽ, Plasma lạnh Mirari có khả năng bất hoạt đa dạng chủng vi khuẩn, kể cả các loại đã kháng kháng sinh, nấm và virus. Tác dụng diệt khuẩn này không dựa trên cơ chế kháng sinh nên không gây ra sự kháng thuốc hay tác dụng phụ nguy hiểm về lâu dài như nhiều phương pháp truyền thống. Ngoài ra, Plasma lạnh còn chủ động điều hòa phản ứng viêm tại vùng vết thương, giảm bớt tình trạng sưng đỏ, đau nhức và tạo điều kiện tối ưu cho tiến trình hồi phục tự nhiên của cơ thể.
Hỗ trợ gia tăng tốc độ lành vết thương
Plasma lạnh Mirari không chỉ giúp kiểm soát tốt nguy cơ nhiễm trùng mà còn kích hoạt các quá trình sinh học tại chỗ như tăng sản xuất yếu tố tăng trưởng, kích thích hình thành mạch máu mới và rút ngắn thời gian tái tạo mô hạt, thúc đẩy quá trình biểu mô hóa – yếu tố cốt lõi giúp đóng vết thương bền vững. Các nghiên cứu lâm sàng đã ghi nhận việc sử dụng Mirari tăng tốc độ đóng vết thương, giảm đau rõ rệt và cải thiện thẩm mỹ cuối cùng cho người bệnh so với chăm sóc truyền thống.
Ứng dụng nổi bật cho các ca vết thương khó lành
Plasma lạnh Mirari phát huy hiệu quả vượt trội trong nhiều tình huống lâm sàng khó khăn, đặc biệt là các trường hợp vết thương phức tạp, mãn tính và dễ biến chứng dưới đây.
- Loét bàn chân do tiểu đường: Plasma lạnh Mirari giúp giảm nhiễm trùng, kích thích lành vết loét “cứng đầu”, hỗ trợ giảm tỷ lệ cắt cụt chi ở bệnh nhân tiểu đường.
- Loét tì đè: Đặc biệt phù hợp cho người già, bệnh nhân liệt giường, plasma lạnh giảm nguy cơ bội nhiễm và ngăn chặn tiến triển loét.
- Vết bỏng, vết mổ sau phẫu thuật: Hỗ trợ giảm đau, phòng ngừa sẹo xấu và co kéo, rút ngắn thời gian nằm viện.
- Vết thương mãn tính, vết loét lâu ngày không lành: Nhờ tác động kháng khuẩn, chống viêm, tái tạo mô đa hướng, Mirari mở ra cơ hội lành vết thương cho nhiều người vốn “bất lực” với điều trị thông thường.
An toàn – Linh hoạt – Dễ sử dụng
Plasma lạnh Mirari mang đến trải nghiệm điều trị tiên tiến với những ưu điểm vượt trội về tiện ích, an toàn và sự thân thiện với người sử dụng. Đó là:
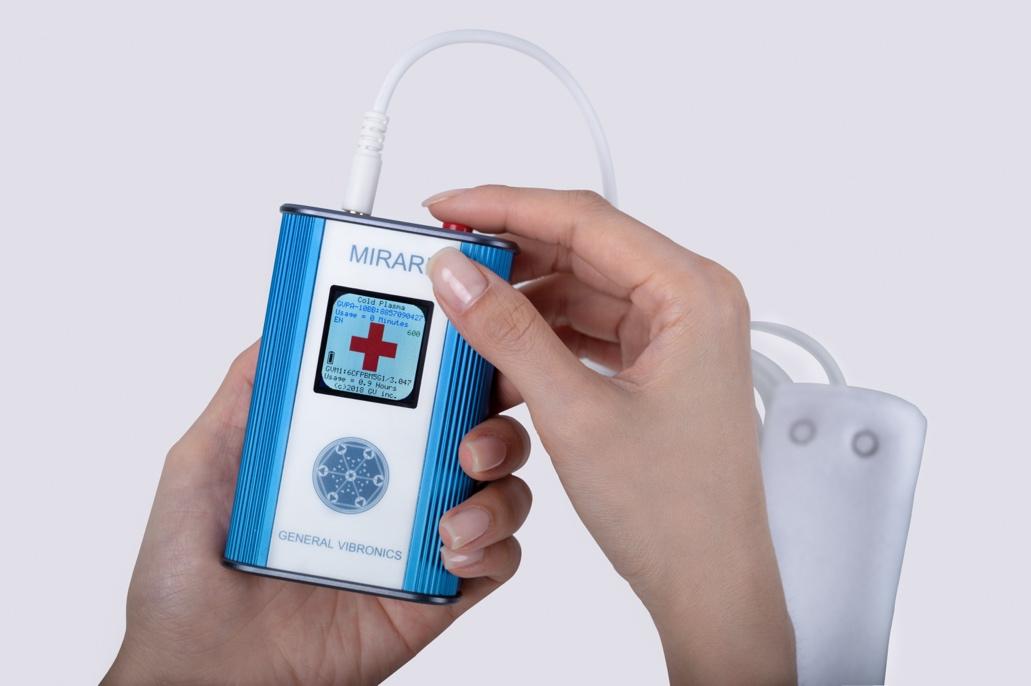
- Thiết kế cầm tay nhỏ gọn, giao diện thân thiện, dễ dàng thao tác ngay cả với những người mới tiếp cận công nghệ.
- Không gây tổn hại mô lành, không đau, hầu như không có thời gian nghỉ dưỡng sau thủ thuật.
- Đã được kiểm nghiệm lâm sàng và xác nhận đáp ứng tiêu chuẩn an toàn quốc tế với nguy cơ tác dụng phụ tối thiểu.
Kết luận
Plasma lạnh Mirari là bước tiến mới trong chăm sóc vết thương, lý tưởng cho các ca loét khó chữa, bỏng, vết mổ, vết thương mãn tính, loét do tiểu đường và loét tì đè. Với khả năng diệt khuẩn vượt trội, kháng viêm chủ động, thúc đẩy tái tạo mô và mức độ an toàn cao, công nghệ này ngày càng được ứng dụng rộng rãi và mang lại kết quả tích cực trong thực tế lâm sàng.
Tài liệu tham khảo
- Fridman, G., Peddinghaus, M., Ayan, H., Fridman, A., Balasubramanian, M., Gutsol, A., Brooks, A., & Friedman, G. (2006). Blood coagulation and living tissue sterilization by floating-electrode dielectric barrier discharge in air. Plasma Chemistry and Plasma Processing, 26(4), 425-442. https://doi.org/10.1007/s11090-006-9024-4
- Heinlin, J., Zimmermann, J. L., Zeman, F., Bunk, W., Isbary, G., Landthaler, M., Maisch, T., Monetti, R., Morfill, G., Shimizu, T., Steffes, B., Karrer, S. (2013). Randomized placebo-controlled human pilot study of cold atmospheric argon plasma on skin graft donor sites. Wound Repair and Regeneration, 21(6), 800-807. https://doi.org/10.1111/wrr.1207
- Julia Heinlin; Gregor Morfill; Michael Landthaler; Wilhelm Stolz; Georg Isbary; Julia L. Zimmermann; Tetsuji Shimizu; Sigrid Karrer (2010). Plasma medicine: possible applications in dermatology. https://doi.org/10.1111/j.1610-0387.2010.07495.x
- J Heinlin; G Isbary; W Stolz; G Morfill; M Landthaler; T Shimizu; B Steffes; T Nosenko; JL Zimmermann; S Karrer (2011). Plasma applications in medicine with a special focus on dermatology. https://doi.org/10.1111/j.1468-3083.2010.03702.x
- Maisch, T.; Shimizu, T.; Isbary, G.; Heinlin, J.; Karrer, S.; Klampfl, T. G.; Li, Y.-F.; Morfill, G.; Zimmermann, J. L. (2012). Contact-Free Inactivation of Candida albicans Biofilms by Cold Atmospheric Air Plasma. https://doi.org/10.1128/AEM.07235-11
- Laroussi M, Leipold F Evaluation of the Roles of Reactive Species, Heat, and UV Radiation in the Inactivation of Bacterial Cells by Air Plasmas at Atmospheric Pressure. Int J Mass Spectrom (2004). https://doi.org/10.1016/j.ijms.2003.11.016
- Brandenburg R, Lange H, Von Woedtke T, Stieber M, Kindel E, Ehlbeck J, et al. Antimicrobial Effects of UV and VUV Radiation of Nonthermal Plasma Jets. IEEE Trans Plasma Sci (2009). https://doi.org/10.1109/tps.2009.2019657
- Schneider S, Lackmann J-W, Ellerweg D, Denis B, Narberhaus F, Bandow JE, et al. The Role of VUV Radiation in the Inactivation of Bacteria with an Atmospheric Pressure Plasma Jet. Plasma Process. Polym (2012). https://doi.org/10.1002/ppap.201100102
- Lange H, Foest R, Schafer J, Weltmann K-D Vacuum UV Radiation of a Plasma Jet Operated with Rare Gases at Atmospheric Pressure. IEEE Trans Plasma Sci (2009). https://doi.org/10.1109/tps.2009.2019982
- Schröder, D ; Bahre, H ; Knake, N ; Winter, J ; de los Arcos, T ; Schulz-von der Gathen, V (2012). Influence of target surfaces on the atomic oxygen distribution in the effluent of a micro-scaled atmospheric pressure plasma jet. https://doi.org/10.1088/0963-0252/21/2/024007
- Rastogi RP, RichaKumar A, Kumar A, Tyagi MB, Sinha RP. Molecular Mechanisms of Ultraviolet Radiation-Induced DNA Damage and Repair. J Nucleic Acids (2010). https://doi.org/10.4061/2010/592980
- Mikkelsen RB, Wardman P Biological Chemistry of Reactive Oxygen and Nitrogen and Radiation Induced Signal Transduction Mechanisms. Oncogene (2003). https://doi.org/10.1038/sj.onc.1206663
- Liedtke, Kim Rouven ; Bekeschus, Sander ; Kaeding, André ; Hackbarth, Christine ; Kuehn, Jens-Peter ; Heidecke, Claus-Dieter ; von Bernstorff, Wolfram ; von Woedtke, Thomas ; Partecke, Lars Ivo (2017). Non-thermal plasma-treated solution demonstrates antitumor activity against pancreatic cancer cells in vitro and in vivo. https://doi.org/10.1038/s41598-017-08560-3
- Daeschlein, Georg ; Scholz, Sebastian ; Arnold, Andreas ; von Podewils, Sebastian ; Haase, Hermann ; Emmert, Steffen ; von Woedtke, Thomas ; Weltmann, Klaus-Dieter ; Jünger, Michael (2012). In Vitro Susceptibility of Important Skin and Wound Pathogens Against Low Temperature Atmospheric Pressure Plasma Jet (APPJ) and Dielectric Barrier Discharge Plasma (DBD). https://doi.org/10.1002/ppap.201100160
- Weltmann, K-D ; Brandenburg, R ; von Woedtke, T ; Ehlbeck, J ; Foest, R ; Stieber, M ; Kindel, E (2008). Antimicrobial Efficacy and Antimicrobial treatment of heat sensitive products by miniaturized atmospheric pressure plasma jets (APPJs). https://doi.org/10.1002/ctpp.200710011
- YijiaoWu, Shiyu Yu, Xiyin Zhang, Xianzhong Wang and Jiaojiao Zhang. The Regulatory Mechanism of Cold Plasma in Relation to Cell Activity and Its Application in Biomedical and Animal Husbandry Practices (2023). https://doi.org/10.3390/ijms24087160
- ATT 3_Section 13_Biocompatibility_Compiled
- ATT 5_Section 15_EMC_and_Safety_Compiled-1
- ATT 6_Section 16_Performance Testing-Bench_Compiled-Final-1
- U.S. Food and Drug Administration. (2020, June 19). Use of International Standard ISO 10993-1, “Biological evaluation of medical devices – Part 1: Evaluation and testing within a risk management process”. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/use-international-standard-iso-10993-1-biological-evaluation-medical-devices-part-1-evaluation-and